    |

 |
|  | |||||||||||||||||||||||||||||||||||||||||||||
Artículos | Ingenierías | BiotecnologíaÉxitos transgénicos: la insulinaPor Vicente Planelles Publicado: Lunes, 16/1/2012 - 9:46 | 4938 visitas.
No obstante, el vínculo entre insulina y diabetes no ha estado siempre tan claro, de modo que inicialmente el único tratamiento conocido para controlar la diabetes era la ingestión de una dieta baja en carbohidratos y alta en proteínas y grasas, que actúan retrasando la asimilación de los azúcares. No fue hasta 1922 cuando se administró por primera vez insulina para tratar la diabetes, concretamente un extracto de hígado de ganado que, debido a las impurezas presentes, producía grandes reacciones alérgicas. Los experimentos avanzaron, intentando encontrar la dosis exacta necesaria para una correcta respuesta del organismo, obteniendo resultados más o menos satisfactorios. La revolución se inicia en 1926, año en que se consigue la cristalización de la proteína(1). Posteriormente, en 1955, Sanger consigue descifrar su composición(2), obteniendo que estaba formada por dos cadenas de 21 y 30 aminoácidos (cadenas A y B, respectivamente) unidas por puentes disulfuro establecidos entre varios residuos de cisteína. El conocimiento de la secuencia y estructura de una molécula es vital, pues ayuda a entender cómo funciona en el organismo, las interacciones que se producen… Hay que destacar que la insulina fue una de las primeras proteínas cristalizadas, y la primera en ser secuenciada. Estructura primaria de la insulina humana Por aquel entonces, 60 años después del primer ensayo realizado en humanos, la insulina que se administraba a los diabéticos se obtenía de vacas y cerdos, con un efecto muy similar al producido por la variante humana, pero también con numerosos problemas de tipo alérgico derivados de las impurezas con las que se obtenía, como por ejemplo erupciones cutáneas. En 1963, la insulina se convirtió en la primera proteína en ser sintetizada in vitro, por Meinhofer y colaboradores(3) , pero con un rendimiento bastante pobre, lo que impedía su utilización masiva contra la diabetes. Así llegamos a la insulina recombinante ya que, en el año 1978, gracias al desarrollo de la ingeniería genética se consigue la síntesis de la insulina mediante técnicas biotecnológicas 4 (una vez más, es la primera proteína en la que se llevan a cabo). El procedimiento llevado a cabo fue muy ingenioso, utilizando las bacterias Escherichia coli (E. coli para los amigos) como factorías en miniatura para producir de forma separada las cadenas A y B de la insulina humana, introduciendo para ello los genes que las codifican en las bacterias mediante un vector (pBR322). Posteriormente se llevaba a cabo la purificación, plegamiento y unión in vitro de las cadenas, mediante la oxidación de las cisteínas para formar los puentes disulfuro de la proteína activa. Proceso de obtención de una proteína recombinante El resultado fue una insulina humana (denominada comercialmente Humulin), más barata de producir, potente y segura, ya que no mostraba los problemas que producían las homólogas animales. Empezó a distribuirse a principios de los años 80 como tratamiento contra la diabetes, siendo (una vez más) la primera proteína recombinante aprobada como medicamento. Hoy en día, prácticamente todos los diabéticos son tratados con algún tipo de insulina recombinante, pues se han conseguido numerosos análogos con diferentes cualidades (de efecto retardado, más potente…). No obstante, la investigación no termina aquí. En los últimos años se está consiguiendo que otros organismos genéticamente modificados produzcan insulina humana, con numerosas ventajas. Por ejemplo, científicos argentinos han obtenido vacas transgénicas que producen leche enriquecida en pro-insulina humana5, que evitarían tener que purificar la proteína, pues únicamente habría que consumir la leche. Lo mismo ocurre con el cártamo (Carthamus tinctorius L., azafrán bastardo), que se ha modificado para que produzca insulina humana en sus semillas.
| ArtículosImágenes
Videos
Noticias
EntradasLibros
| ||||||||||||||||||||||||||||||||||||||||||||||

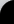
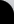

 Imagen: Agencias / Internet
Imagen: Agencias / Internet



